Катодная и протекторная защита металлов от коррозии. Протекторная защита металла: холодное цинкование. Разновидности катодной защиты
Электрохимическая защита от коррозии
1. Катодная защита
2. Протекторная защита
3. Анодная защита
1. Наиболее важный метод борьбы с коррозией – катодная защита. Она заключается в приложении к корродирующему металлу катодной поляризации внешним током. При этом не происходит разрушение металла в течение длительного времени.
В зависимости от основного материала, но в основном в зависимости от места их возникновения, различают различные типы коррозии. В качестве поверхностной коррозии относится, например, эта форма окисления металла, которая равномерно распространяется по всей поверхности пораженного компонента. Однако питтинг возникает, когда затрагиваются только определенные пятна на поверхности компонента. Если разложение происходит главным образом в структурных или склеиваемых зонах, также рассматривается селективная коррозия.
Это особенно характерно, когда встречаются разные металлы, причем более благородный из них вызывает разложение другого. Как защита от коррозии, все меры, как правило, упоминаются, которые имеют целью экранирование компонентов от так называемых коррозионных сред. Применение соответствующих средств и процедур сегодня, как правило, является неотъемлемой частью любого специалиста по профессиональным художникам. В принципе, проводится различие между активной и пассивной защитой от коррозии.
На практике катодную защиту можно применять для предупреждения – коррозии стали, меди, свинца, латуни в почве и в водных средах.
Коррозионное растрескивание под напряжением латуней, сталей (в т. ч. нержавеющих), магния, алюминия ;
Межкристаллическую коррозию нержавеющих сталей.
Защита кузовов автомобилей от коррозии
Активная защита от коррозии относится к специальным мерам, которые не направлены на выделение защищаемого компонента, но активно вмешиваются в процесс электрохимической реакции, даже провоцируя его. В этом конкретном виде защита от ржавчины поврежденного материала снабжена так называемым жертвенным анодом. Обычно это основной металл. В соответствии с принципом контактной коррозии это предпочтительно подвергается воздействию коррозионного процесса, в то время как более благородный металл не повреждает.
Невозможно применение катодной защиты для непроводящих сред (атмосфера) и для электрически экранированных поверхностей.
История применения катодной защиты.
В 1824 г. англ. Х. Дэви сообщил, что медь можно успешно защищать от коррозии в соленой воде, если обеспечить ее контакт с железом или цинком. Он предложил осуществлять защиту медной обшивки кораблей с использованием прикрепленных к корпусу жертвенных железных блоков. В то время метод не получил развития, т. к. медь, катодно защищенная, обрастала микроорганизмами. И вплоть до 1950 г. возможность применения катодной защиты морских судов не изучалась.
Общие меры в контексте активной защиты от коррозии, например, гальванизация стальных компонентов или различных форм сплава. Сегодня многие компоненты, предназначенные для использования на открытом воздухе, уже доступны в горячем цинковании. В целом, однако, активная защита от коррозии, скорее всего, будет использоваться в промышленном секторе. Часто, например, гидротехнические сооружения или суда снабжены соответствующими сплавами. В этой статье. В домашних условиях более распространенными являются все меры, которые относятся к категории пассивной защиты от коррозии.
Впервые положение внешнего электрического тока (-) было применено для защиты подземных сооружений в Англии и США в гг. В настоящее время катодной защитой эффективно защищают тысячи км подземных трубопроводов и кабелей. Применяют также катодную защиту для емкостей, баков, нефтяных установок и химического оборудования.
Теория катодной защиты.
Это включает все процедуры, направленные на защиту материала от агрессивных сред и, таким образом, прекращение процесса коррозии как можно дольше. В основном это относится ко всем видам защитных покрытий и покрытий, таких как нанесение специальных красок или лаков, которые специально разработаны для защиты от ржавчины, например, путем добавления порошка цинка. В этой области также используется покрытие с пластмассами, синтетическими смолами или маслами. Подобным же образом получается технология гальванопокрытия, в которой с помощью электромагнетизма создаются тонкие покровные слои олова, золота, никеля, меди или хрома.
Рассмотрим поляризационную коррозионную диаграмму, иллюстрирующую принцип катодной защиты.
Эти потенциалы отвечают образованию гидроксидов соответствующих металлов Ме(ОН)2, которыми покрыта поверхность металлов.
Особенности катодной защиты
В конечном итоге также учитываются конструктивные меры по методам пассивной защиты от коррозии. Такие, как общее избегание больших скоплений воды в зоне, находящейся под угрозой, через навесы, обшивку и т.д. Эффективная защита от коррозии - более чем разумная инвестиция в долгосрочной перспективе. Однако важно, чтобы это было проведено, если необходимо, экспертно. Желаемый компонент только с имеющейся в продаже антикоррозийной краской или для подметания часто не приводит к желаемому результату. В худшем случае такие косметические процедуры могут сделать проблему еще хуже, просто маскируя фактический урон.
Перезащита – превышение Iзащ над величиной, полученной по коррозионной диаграмме рис. 1
Незначительная перезащита не приводит к значительным отрицательным последствиям, только при этом происходят потери электроэнергии и увеличивается расход вспомогательных анодов. При значительном превышении защитной плотности тока возникают условия для дополнительного разрушения металла, вследствие выделения Н2 (охрупчивание стали, отслаивание покрытий).
Если заражение уже существует, это в идеале должно быть оценено квалифицированным художником. Установив тип коррозии и источник - коррозионную среду и благоприятные факторы, можно дать компетентные рекомендации по имеющимся вариантам. Даже при новых покупках может быть целесообразно получить информацию о любых необходимых мерах защиты от коррозии во время его установки. Часто простой праймер с подходящим антикоррозионным средством может значительно увеличить долговечность многих компонентов.
Особенно с металлическими компонентами коррозия создает серьезную угрозу для ее функционирования и жизни. Коррозия не то же самое, что и коррозия. Любой, кто хочет эффективно работать против ржавчины, нуждается в экспертном знании типов и характеристик различных типов коррозии. Профессиональная защита может варьироваться от легирования компонента до покрытия специальными красками и лаками на основе различных мер. Вы получите компетентный совет от квалифицированного мастера-живописца.
Большую опасность представляет перезащита амфотерных металлов (Al, Zn). Создается щелочная среда, в которой эти металлы разрушаются с водородной деполяризацией.
2. Протекторная защита – разновидность катодной защиты, присоединение к «-» металлу.
Протекторную защиту целесообразно использовать в тех случаях, когда катодная защита невозможна (нет источника постоянного тока).
Вы сильно затронули или хотели бы увеличить долговечность металлического компонента? Защита от ржавчины стальных конструкций в море знает многие концепции. Особенно для верхних зон опорных конструкций ветротурбины существует надежное решение. Зачастую вставляются в морскую воду, металлы начинают неравный бой с окружающей средой. Вода в открытом море хорошо оборудована для разложения металлических инородных тел, соль улучшает ее проводимость и делает ее более отзывчивой. Металлические ионы и электроны, в частности, оставляют свой родительский материал в заполненной кислородом области брызг воды и находят свое новое состояние в кислороде и соединениях водорода.
Проволоку припаивают к стальному наконечнику, который приваривают к трубе электродуговой сваркой. На трубопроводах, защищенных покрытием, изолируют место контакта и все открытые участки металла.
Негативное действие электрохимической коррозии
Оффшорные опорные структуры могут проиграть только эту битву - если только они недостаточно защищены. Когда люди переходили от дерева к металлу для перемещения по воде, они разработали два процесса, которые защищают свое оборудование от коррозии: сегодня покрытия на основе корпусов кораблей из полиуретана или эпоксидной смолы и морских и морских морских конвейеров в переходной зоне между спреем и подводной зоной от враждебной среды. В подводной зоне жертвенные аноды обеспечивают катодную защиту от коррозии.
Экономические аспекты катодной защиты
Для подземных трубопроводов стоимость катодной защиты намного ниже, чем при использовании любых других способов, обеспечивающих аналогичную эффективность. В катодно защищенных трубопроводах исключены сквозные разрушения, что позволяет применять более высокие давления при транспортировке нефти и газа. Благодаря этому толщина труб определяется только внутренним давлением. В современных условиях при катодной защите с использованием тока или протекторов используется одновременно лакокрасочные (при обычной температуре), эмалевые (при повышенной температуре) и различные изоляционные покрытия (битумные , каменноугольные и др.). Распределение защитного тока более экономично, необходимое число протекторов и величина защитного тока меньше, а участок трубопровода, защищаемый одним анодом, больше. Так, с помощью одного магниевого протектора можно защищать до 8 км трубопровода с покрытием. Для непокрываемого трубопровода защита простирается лишь на 30 м.
Список использованной литературы
Расходуемый анод представляет собой кусок основного металла, который используется для защиты частей других металлов от коррозии. В алюминиево-алюминиевых судовых гребных винтах, которые толкают суда через агрессивную морскую воду, часто используются цинковые блоки. Они прикрепляются к корпусу судна с помощью винтовых или склеенных соединений и окружают пропеллеры. Эта концепция также была принята оффшорной промышленностью: в уязвимых районах сварные цинковые аноды защищают морские стальные конструкции.
Предельная длина участка трубы, защищаемого одним анодом, определяется величиной снижения потенциала защиты по формуле:
Ek=EA*e(-2πRL/kz)1/2X
Ех – потенциал на расстоянии х от места соединения с источником постоянного тока;
ЕА – потенциал источника тока;
RL – сопротивление трубы единичной длины и радиуса r;
k – константа;
Другой формой защиты от коррозии, применяемой к морским сооружениям в течение 50 лет, является оболочка особо напряженных стальных компонентов на сплавах на основе меди. Так как степень коррозии менее выражена в шести зонах офшорной опорной конструкции, различные концепции защиты ржавчины вдоль опорной конструкции необходимы.
Самая высокая скорость коррозии происходит в зоне зоны распыленной воды. Повторяющийся контакт с богатой кислородом морской водой под абразивноподобным эффектом волн значительно увеличивает коррозию. Также область ниже средней низкой воды показывает повышенную коррозионную атаку. Здесь образуются так называемые вентиляционные ячейки из-за хорошей подачи кислорода. По сравнению с приливной зоной здесь происходит анодный эффект.
z – сопротивление единицы поверхности покрытой трубы.
3. Анодная защита
Применяется при транспортировке концентрированной H2SO4, фосфорной кислоты, солевых растворов:
Нержавеющая сталь в 0,5 М Na2 SO4
0,1-0,7 M щавелевой кислоты при 50 0С.
При наличии в растворе Cl - существует опасность развития точечной коррозии (питтинг). Анодная защита применима только для таких металлов и сплавов, которые легко пассивируются при анодной поляризации и для которых i пасс низка.
Цинк - жертва для стали
В зоне постоянной иммерсии жертвенные аноды могут обеспечивать катодную защиту. Для этой цели опорные конструкции должны постоянно контактировать с морской водой, поскольку это действует как электролит. Вода обеспечивает непрерывный перенос заряженных частиц и, таким образом, закрывает контур. Без защиты жертвенного анода металл теряет электроны, которые реагируют с водой и кислородом. Потеря электронов делает молекулу металла катионом, положительно заряженной молекулой. Для восстановления баланса заряда в раствор попадают положительно заряженные молекулы металла.
Для анодной защиты, в отличии от катодной, характерно, что скорость коррозии хоть и мала, но не равна 0. Но, с другой стороны, в агрессивных кислотах необходима значительно более низкая плотность тока, чем при катодной защите. Также при анодной защите достигается высокая рассеивающая способность (т. е. защита на удаленном от катода расстоянии). Это связано с высокими защитными свойствами образуются на аноде продуктов.
Чтобы предотвратить это, установлен жертвенный анод. Поскольку он менее благородный, чем металл, который защищается, ток течет от него к более благородному металлу, а он выделяет его электроны и разъедает бесполезность. Антикоррозийная защита морских стальных компонентов с использованием систем покрытия на основе полиуретана и эпоксидной смолы имеет ограниченный срок службы намного ниже, чем у морских установок. Таким образом, все эти системы защиты от коррозии с регулярными интервалами нуждаются в усовершенствованиях или запасных частях.
При анодной защите титана и сплавов титана токами в несколько мкА/см2 снижение скорости коррозии составляет:
В 40 % H2 SO4 – в 33000 раз
В 35 % H3 PO4 – ~ в 2000 раз
В конц. HCl – ~ в 670 раз
25 % щавелевой – ~ в 330 раз
За счет анодной поляризации от внешнего источника электрической энергии можно перевести способный к этому металл в пассивное состояние и тем уменьшить скорость коррозии на несколько порядков.
Особенно в переходной области это связано со значительными усилиями и затратами. Более эффективная защита от коррозии обеспечивается обшивкой стальных конструкций и корпусов судов медно-никелевым листом с содержанием никеля в десять процентов. Несмотря на то, что в промышленности изначально обработанные сплавы, содержащие высокое содержание никеля, чуть позже, по соображениям стоимости, он переключился на теперь улучшенные сплавы на основе меди.
Анодная защита. Использование пассивности в практике защиты от коррозии
Медно-никелевый сплав хорошо податливый и обладает очень хорошей пластичностью, который не разрушается при перегрузке, а изначально деформируется. Оба элемента полностью смешиваются во всей области легирования и образуют кристаллическую решетку с кубической гранью, что упрощает сварку сплава. Однородность структуры медно-никелевого материала также улучшает дальнейшую обработку, в частности, в отношении свариваемости. Это облегчает введение и поддержание необходимой температуры сварки в области сварки, поэтому часто можно отказаться от предварительного нагрева.
Требования к анодной защите
Существуют требования, которым должна удовлетворять система, чтобы к ней можно было применить анодную защиту.
1. Прежде всего, нужно надежно знать анодную поляризационную кривую для выбранного металла в данной агрессивной среде рис.4. Чем выше i П, тем большая сила тока потребуется для перевода металла в пассивное состояние; чем шире диапазон ∆EП, тем большие колебания потенциала можно допустить, т. е. тем легче поддерживать металл в пассивном состоянии.
Как работает анодная методика?
Кроме того, можно получить содержание никеля, диапазон плавления, вместо температуры плавления, как в меди. Этот диапазон плавления делает сварной шов более гладким и более управляемым. По сравнению с другими сплавами он также не имеет склонности к коррозионному растрескиванию. Допуск на коррозию для применения в морской воде составляет всего 0, 50 миллиметра за 20 лет. В отличие от обычной стали, сплав препятствует росту структур.
Как выполняется катодная схема?
Пространство заполнено полимером или бетоном, который защищает два металла друг от друга электрически. В этом методе оба металла не влияют. Во втором случае два металла электрически соединены путем прямой сварки. Поскольку сплав меди обладает более благородным электрическим потенциалом, чем сталь, теоретически можно ожидать ускоренную коррозионную атаку в переходной зоне от оболочки к незащищенной стали из-за гальванических эффектов.
2. Нужна уверенность в том, что в области ∆EП металл корродирует равномерно. В противном случае, даже при малой величине iПП, возможно образование язв и сквозного разъедания стенки изделия. Форма защищаемой поверхности может быть довольно сложной, что затрудняет поддержание одинакового значения потенциала на всей поверхности; в этом отношении большая величина ∆EП особенно желательна.
3. Хорошая электропроводность среды.
Анодная защита может осуществляться несколькими способами.
1. Простое наложение постоянной э. д.с. от постороннего источника электрической энергии. Положительный полюс подключается к защищаемому изделию, а около его поверхности помещают катоды сравнения малого размера. Они размещаются в таком количестве и на таком расстоянии от защищаемой поверхности, чтобы обеспечить по возможности равномерную анодную поляризацию изделия. Этот способ применяется в том случае, если ∆EП достаточно велик и нет опасности, при некоторой неизбежной неравномерности распределения потенциала анода, активации или перепассивации, т. е. выхода за пределы ∆EП.
Таким способом можно защищать изделия из титана или циркония в серной кислоте. Нужно только помнить, что для пассивации сначала потребуется пропускание тока большей силы, что связано с переводом потенциала за ∆EП. Для начального периода целесообразно иметь дополнительный источник энергии. Следует учитывать также большую поляризацию катодов, плотность тока на которых велика вследствие их малых размеров. Однако, если область пассивного состояния велика, то изменение потенциала катода даже на несколько десятых вольта не представляет опасности.
2. Периодическое включение и выключение тока защиты, когда изделие уже запассивировано. При выключении анодного тока потенциал изделия смещается в отрицательную сторону, причем может произойти депассивация. Но поскольку иногда это происходит довольно медленно, простая автоматика может обеспечить включение и выключение защитного тока в нужное время. Когда потенциал дойдет до величины E′ПП, т. е. до начала перепассивации, ток выключается; когда потенциал сдвинется в отрицательную сторону до EПП (начало активации), ток снова включается. Смещение потенциала в катодную сторону происходит тем медленнее, чем меньше i ПП. Чем ближе был потенциал к величине E′ПП, тем медленнее он смещается в отрицательную сторону (в направлении EПП) при выключении тока. Например, для хрома в 0,1 Н растворе H2 SO4 при 75 0С, если выключение тока произошло при E=0,35В, активация наступит через 2 часа; выключение тока при E=0,6В вызовет активацию через 5 часов; выключение же при E=1,05В увеличивает срок начала активации более чем до 127 часов. Столь большое время, необходимое для депассивации, позволяет делать значительные перерывы в подаче тока. Тогда одной и той же установкой можно обслужить несколько объектов.
3. Если область пассивного состояния (∆EП) мала, то необходимо применение потенциостата, поддерживающего заданную величину потенциала (относительно некоторого электрода сравнения) в узких границах. Потенциостат должен быть способен давать большую силу тока.
Недостатки анодной защиты
Использование анодной защиты связано со значительными трудностями. В то время как катодная защита может употребляться для защиты многих металлов, погруженных в любую электропроводящую среду, например твердую или жидкую, анодная защита применяется только для защиты целых секций химических установок, которые изготовлены из металла, способного пассивироваться в рабочей среде. Именно это и ограничивает ее применение. Кроме того, анодная защита потенциально опасна, поскольку при перерывах подачи тока без немедленного восстановления защиты на рассматриваемом участке начнется очень быстрое растворение, т. к. разрыв в пленке образует путь с низким сопротивлением в условиях анодной поляризации металла.
Использование анодной защиты требует тщательного проектирования химической установки. Последняя должна иметь такую систему контроля, чтобы любая потеря защиты немедленно привлекла внимание оператора. Для этого может быть достаточным только локальное повышение анодного тока, однако в наихудшем случае может потребоваться немедленное опорожнение всей установки.
Анодная защита не обеспечивает стойкости в присутствии агрессивных ионов. Так, хлоридные ионы разрушают пассивную пленку, а потому их концентрация должна поддерживаться низкой, за исключением защиты титана, который может пассивироваться в хлористоводородной кислоте.
Защитить кузов своего авто от коррозии или по крайней мере уменьшить ее интенсивность – желание каждого автовладельца. И мы в этом плане не исключение. Несмотря на то, что наши кузова пластиковые и не подвержены коррозии, много скрытых металлических элементов кузова все же ржавеют не смотря на цинковое покрытие. И чем старше становятся наши автомобили, тем меньше остается цинка и тем больше это явление проявляется. Особенно коррозии подвержены скрытые полости лонжеронов, колесные арки, подрамник и днище автомобиля. Способов защиты от ржавчины не так уж и много – это механические, химические и электрохимические. В простейшем случае: увидел ржавчину – зачисти, загрунтуй и покрась. Однако такой способ хоть и дает результат, но не является удобным и эффективным. Обрабатывать все подряд преобразователями ржавчины (как правило на основе ортофосфорной кислоты) – тоже не выход, так как все равно нужно очищать ржавые поверхности хотя бы от рыхлой ржавчины, а затем наносить преобразователь и следом защитное покрытие. А как обработать скрытые полости лонжеронов, узкие щели? Есть еще один способ – электрохимический или катодная защита. Он основан на всем известных со школьного курса принципах и уже давно применяется в судостроении, при прокладке трубопроводов да и в других отраслях.
 Странно, что применение этого способа не распространено в автомобилестроении. Наверное это не выгодно самим производителям – автомобильный парк должен обновляться. Сложного в этом ничего нет несмотря на страшное для непосвященного названия. И вот чтобы убедиться в этом полез в интернет. Нашлось много рекламы по продаже и установке уже готовых устройств.
Странно, что применение этого способа не распространено в автомобилестроении. Наверное это не выгодно самим производителям – автомобильный парк должен обновляться. Сложного в этом ничего нет несмотря на страшное для непосвященного названия. И вот чтобы убедиться в этом полез в интернет. Нашлось много рекламы по продаже и установке уже готовых устройств.
Естественно, что производители скрывают конструкцию таких устройств, однако на то и интернет. Все устройства работают по одному принципу – создание разности потенциалов между железом кузова и дополнительными электродами. Различие лишь в применении внешних источников питания или отсутствии оных. Конечно и различные схемы контроля состояния данных устройств, увеличивающие стоимость таких устройств на порядок и выше, но без которых вполне можно обойтись. Рассмотрим несколько вариантов из найденных во всемирной паутине (сохраню по возможности стиль авторов):
Андрей Космос и его сайт http://www.womanbusiness.ru. Описываемое устройство легко может сделать каждый автолюбитель из недефицитных деталей. Это устройство аналогично тем изделиям (антикорам), которые в настоящее время имеются в продаже, однако стоимость его в несколько раз ниже.
Основное отличие предлагаемого устройства от промышленных состоит в том, что с целью упрощения в нем отсутствуют элементы, сигнализирующие о работоспособности устройства. Однако высокая надежность устройства и соблюдение простейших условий эксплуатации делают эти элементы излишними.
Электрическая схема простейшего устройства приведена на рис. 3.
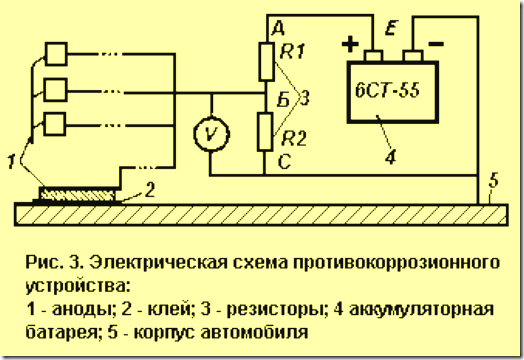 Устройство содержит простейший делитель напряжения, выполненный на двух резисторах сопротивлением R1 и R2 соответственно. Верхний по схеме вывод резистора R1 соединен с положительным выводом аккумулятора, нижний по схеме вывод резистора R2 соединен с отрицательным выводом. При таком соединении резисторов в точке Б относительно метала кузова автомобиля будет положительный потенциал V1, который определяется из выражения:
Устройство содержит простейший делитель напряжения, выполненный на двух резисторах сопротивлением R1 и R2 соответственно. Верхний по схеме вывод резистора R1 соединен с положительным выводом аккумулятора, нижний по схеме вывод резистора R2 соединен с отрицательным выводом. При таком соединении резисторов в точке Б относительно метала кузова автомобиля будет положительный потенциал V1, который определяется из выражения:
U = Е * R2/(R1 + R2);
где Е - напряжение аккумулятора (в нашем случае примем 12 В).
Потенциал U должен быть равен защитному потенциалу, при котором прекращается процесс коррозии. При последовательном соединении резисторов через них течет ток, равный I = E/(R1 + R2)
Сила тока (0.1-100 мА) выбирается из условия, что при обычной влажности один анод надежно защищает примерно 4-10 дм2 площади. R2 = V/I; R1 = (E/I) – R2
Если по каким-либо причинам необходимо изменить значения защитного потенциала или силу тока, соответствующие значения сопротивлений резисторов могут быть определены из приведенных соотношений. К точке 1 делителя необходимо припаять длинные провода (в изоляции), к другим концам которых припаять стальные пластины-аноды.
Каждый анод представляет собой пластину из низкоуглеродистой стали прямоугольной формы размерами примерно 2х2 см. Для защиты можно использовать и внешние аноды, о чем будет сказано далее. Предлагаемое устройство превращает корпус автомобиля в катод, который в процессе эксплуатации будет восстанавливаться за счет окисления анодов. Конструкция устройства - произвольная.
В простейшем случае делитель можно расположить на небольшой изоляционной пластине (гетинакс, пластмасса), верхний вывод резистора R1 и нижний резистора R3 закрепить на этой пластине с помощью винтов, а остальные выводы припаять к металлической пластине, к которой провода от анодов могут также закрепляться с помощью винтов (рис. 4).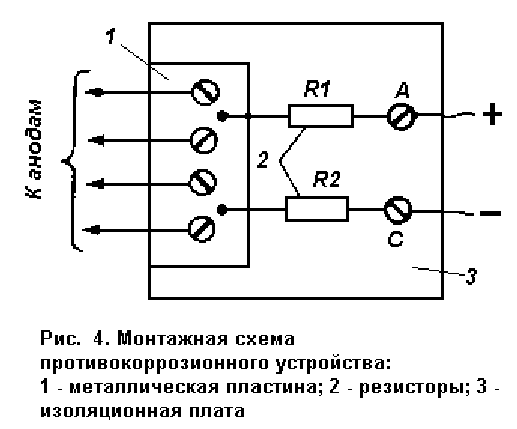 Все устройство необходимо поместить в какую-либо изоляционную коробочку или залить эпоксидной смолой. Устройство удобно разместить в моторном отсеке автомобиля вблизи аккумулятора. Противокоррозионные устройства, поступающие в продажу, имеют определенные средства контроля - светодиоды, сигнализирующие о включении устройства и о пропадании потенциала в точке К. Подобное контрольное устройство (например, триггер Шмидта) можно добавить и предлагаемое устройство.
Все устройство необходимо поместить в какую-либо изоляционную коробочку или залить эпоксидной смолой. Устройство удобно разместить в моторном отсеке автомобиля вблизи аккумулятора. Противокоррозионные устройства, поступающие в продажу, имеют определенные средства контроля - светодиоды, сигнализирующие о включении устройства и о пропадании потенциала в точке К. Подобное контрольное устройство (например, триггер Шмидта) можно добавить и предлагаемое устройство.
Однако проще 1 раз в месяц замерить потенциал на выходе устройства в точке Б и убедиться в его работоспособности, тем более что визуальный контроль все равно необходим. Кроме того, введение контрольных элементов увеличивает потребляемую силу тока с 1 до 10 мА, ограничивает тот период времени, в течение которого можно не подзаряжать аккумулятор. Это время можно оценить по следующей методике.
Из руководства по эксплуатации автомобиля, да и из собственной практики автомобилист знает, что устойчивый пуск двигателя с помощью стартера возможен, если емкость аккумулятора составляет не менее 60% номинальной. Если использовать готовое устройство с током потребления 5 мА, то время, в течение которого аккумулятор можно не подзаряжать (Т) составляет 40 дней. С учетом саморазряда аккумулятора это время будет еще меньше. Предлагаемое же устройство фактически не разряжает аккумулятор (время Т при его использовании может составлять более года), что особенно важно при длительном хранении автомобиля.
Многим автолюбителям известно, что достаточно появиться небольшой царапине – и ржавчина начинает прямо-таки поглощать автомобиль. Какие только хитрости ни придумывают автомобилисты – различные покрытия, мастики, антикоры… Да вот беда: чтобы обработать с должным качеством все наиболее поражаемые места, приходится порой разбирать весь автомобиль. Поэтому вполне понятно желание автомобилистов приобрести чудо-прибор: один раз потратился и навсегда защитил кузов от ржавчины.
Метод катодной защиты от коррозии уже давно применяется на самых разнообразных объектах. Например на кораблях устанавливают специальные протекторы, которые, растворяясь в морской вода, обеспечивают защиту корпуса судна. Подземные трубопроводы перед укладкой обрабатывают антикоррозийными составами и обматывают специальной лентой. На определенном расстоянии от трубопровода закапывают анод (электрод) – металлическую болванку, к которой подключают “плюс” источника постоянного тока, а к самой трубе – “минус”. Благодаря разности потенциалов между электродом и защищаемым металлом в цепи образующегося электролита (влага, соль и т.п.) проходит ток. На аноде происходит освобождение электронов – реакция окисления, и саморастворение катода прекращается .
При катодной поляризации металлу нужно сообщить такой отрицательный потенциал, при котором его окисление становится термодинамически маловероятным. Для железа и его сплавов полная защита от коррозии достигается при потенциале 0,1…0,2 В. Дальнейший сдвиг потенциала мало влияет на степень защиты. Плотность защитного тока должна быть в пределах 10…30 мА/м2.
Кроме того, со временем на металле за счет концентрационной поляризации по кислороду наблюдается дополнительное смещение потенциала в отрицательную сторону, что позволяет периодически выключать устройство (при ремонте автомобиля, зарядке аккумулятора и т.п.).
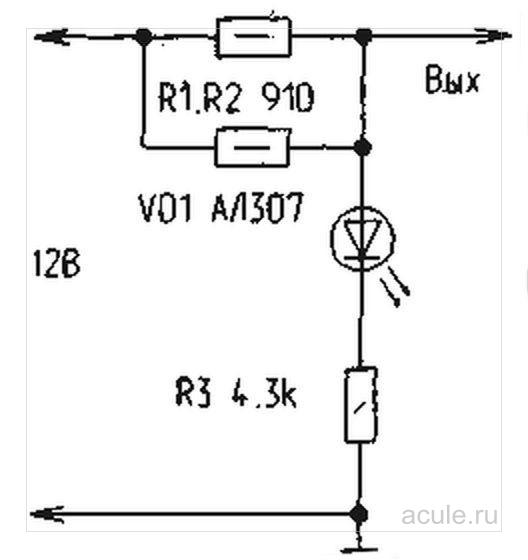
 Устройство защиты от коррозии состоит из электронного блока и защитных электродов. На корпусе электронного блока размещают световую индикацию работы устройства. Устройство позволяет поддерживать значение потенциала влажных участков поверхности кузова на уровне, необходимом для полной остановки и прекращения коррозийных процессов за счет разрушения защитных электродов.
Устройство защиты от коррозии состоит из электронного блока и защитных электродов. На корпусе электронного блока размещают световую индикацию работы устройства. Устройство позволяет поддерживать значение потенциала влажных участков поверхности кузова на уровне, необходимом для полной остановки и прекращения коррозийных процессов за счет разрушения защитных электродов.
В качестве защитных электродов (анодов) могут использоваться как разрушающиеся материалы (нержавеющая сталь, алюминий), требующие замены через 4…5 лет, так и неразрушающиеся. В качестве неразрушающихся электродов можно применять карбоксил, магнетит, графит или платину. Защитные электроды выполняются в виде прямоугольных либо круглых пластин площадью 4…9 см2.
На рисунке приведена схема простого антикоррозийного устройства, которое может успешно справляться с явлениями коррозии. Конечно, в простейшем виде устройство катодной защиты может состоять из защитных электродов и проводов, подключаемых непосредственно на “плюсовую” клемму аккумулятора. Однако здесь трудно контролировать возможное короткое замыкание электродов с кузовом автомобиля и его работу в целом. Для этого в устройстве в цепь делителя напряжения Rl, R2, R3 включен светодиод VD1, который в рабочем режиме светится ровным светом, потребляя незначительный ток от аккумулятора (около 2 мА).
Если вдруг один из защитных электродов замыкается на кузов автомобиля, светодиод VD1 прекращает светиться. В этом случае необходимо найти и устранить замыкание. При повышенной влажности кузова светодиод VD1 может в небольших пределах изменять свое свечение, что указывает на работу катодной защиты. Кроме того, данное устройство имеет высокую надежность, поскольку дает при коротком замыкании выхода с кузовом ток перегрузки не более 25…30мА.
При установке и монтаже устройства следует помнить, что:
— один защитный электрод защищает площадь с радиусом около 0,25…0,35 м;
— защитные электроды устанавливаются только на места, защищенные лакокрасочным покрытием;
— использовать можно только эпоксидный клей или шпатлевку на его основе;
— наружную сторону защитных электродов (где нет пайки) нельзя покрывать мастикой, краской, клеем или другим электроизоляционным покрытием.
Электронный блок устанавливается в любом месте автомобиля и присоединяется к общей схеме электрооборудования автомобиля. При этом необходимо, чтобы электронный блок оставался включенным даже при отключенном общем электрооборудовании автомобиля.
В целом устройство потребляет не больше чем часы автомобиля и гарантирует длительную эффективную работу даже при сильно разряженном аккумуляторе.
И еще один вариант – тот же принцип, но без применения источников питания (сайт здесь). Он основан на применении металлов с различной электроотрицательностью (см. таблицу Менделеева). Как правило в этом случае используется для разрушаемых электродов наиболее доступный металл – цинк. Хотя можно подобрать и другой:
Катодная защита кузова от коррозии
Ржавчина – враг номер один почти любого металла. «Рыжая чума», с завидным упорством и постоянством превращающая сотни тонн сверкающей высокосортной, легированной стали в груды коричневого порошка. Болезнь, для которой не существует преград… Но существуют лекарства и от нее: гальванические покрытия, лаки и краски, битумы и мастики - все они в принципе должны защитить металл. Но на деле все не так просто.
Очень остро проблема защиты от коррозии стоит, к примеру, перед автомобилистами. Общеизвестно, что если не принимать определенных мер, то кузов автомобиля в течение четырех-пяти лет может превратиться буквально в ржавое решето. Зачастую не помогают ни лакокрасочные покрытия, ни мастики, поскольку кузов имеет немало закрытых полостей, пазух, карманов, коробов, в которых дорожная грязь и сырость, замешанные на поваренной соли, создают великолепные условия для электрохимической коррозии. А при современной толщине автомобильного стального листа это приводит к весьма быстрому его выходу из строя.
Но от коррозии можно не только защищаться броней из лака или хрома, ее можно и обмануть, подсунув в виде приманки такой лакомый кусочек, как металл с более высоким электродным потенциалом.
Электродный потенциал? А какое он, собственно, имеет отношение к коррозии металлов? Оказывается, самое непосредственное.
Если опустить в сосуд с электролитом два электрически связанных между собой металлических электрода, то один из них начнет растворяться, другой же останется в неприкосновенности. Так вот, оказывается, растворяется металл, электродный потенциал которого выше. Это свойство гальванической пары и дало возможность использовать эффект сохранения катода для предохранения от электрохимической коррозии кузова автомобиля.
Судостроители давно уже используют этот принцип предохранения внутренней части трюма от коррозии – они размещают внутри корпуса специальные металлические аноды (из металла с более высоким электродным потенциалом, чем у металла корпуса). Этот способ недавно взяли на вооружение и автомобилисты.
Для анодной защиты применяют оребренные (для увеличения поверхности) куски цинка С помощью вделанных в них постоянных магнитов они прикрепляются в наиболее труднодоступных и загрязняемых местах кузова. Электрическая связь осуществляется многожильным проводом: с помощью винтов цинковый анод подсоединяется к кузову.
На его ребрах собирается дорожная грязь, влага, поваренная соль и комплект «цинк - сталь» начинает работать так, как работает всем известный гальванический элемент. При работе такой «батареи» происходит растворение цинкового анода, катод в данном случае не расходуется.
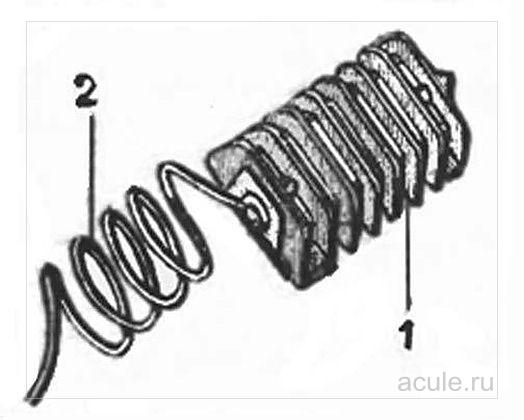 Рис. 1. Комплект для анодной защиты кузова автомобиля:
Рис. 1. Комплект для анодной защиты кузова автомобиля:
1 – оребренный цинковый электрод, 2 – соединительный провод.
Процесс коррозии напоминает работу гальванического элемента, поскольку сталь представляет собой, в основном, сплав железа и углерода, то есть веществ с различными электродными потенциалами. При попадании на поверхность такого сплава электролита между молекулами железа и углерода начинает идти электрохимическая реакция, сопровождающаяся растворением анода (железа) и переходом его в гидраты, а затем и в окислы.
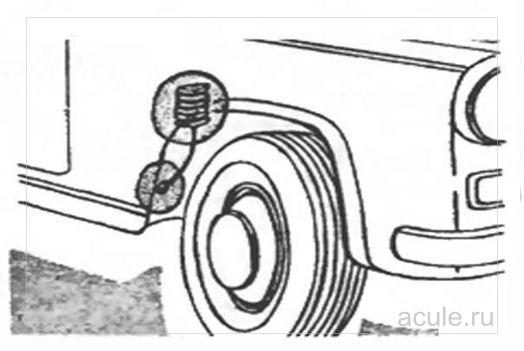 Рис. 2. Установка электрода в колесной нише.
Рис. 2. Установка электрода в колесной нише.
Присутствие же электрически связанного с основным металлом цинкового электрода в корне меняет картину. По отношению, как к железу, так и к углероду цинк представляет собой металл с более высоким электродным потенциалом, то есть выступает в роли анода. Поэтому при наличии электропроводной среды, которая практически всегда присутствует на поверхностях автомобильного кузова, электрохимическая реакция идет с растворением анода (цинка), при сохранении катода, то есть металла кузова.
Рис. 3. Установка электродов в этих точках наиболее эффективна:
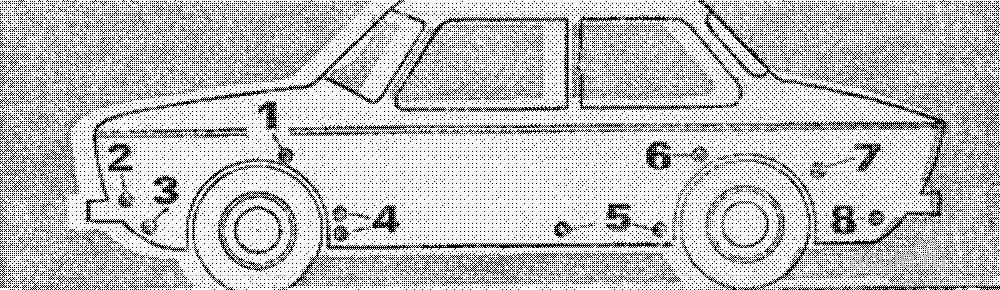 1 – коробчатые усилители брызговиков, 2 – места крепления корпусов фар и подфарников, 3 – нижняя часть передней панели, 4 – полости за щитками-усилителями передних крыльев, 5 – внутренние поверхности дверей, 6, 7 – передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 – фартук задней панели.
1 – коробчатые усилители брызговиков, 2 – места крепления корпусов фар и подфарников, 3 – нижняя часть передней панели, 4 – полости за щитками-усилителями передних крыльев, 5 – внутренние поверхности дверей, 6, 7 – передняя нижняя часть заднего крыла и арка колеса по стыку с крылом, 8 – фартук задней панели.
Как показали эксперименты, цинкового электрода величиной со спичечную коробку хватает на 3-5 лет.
Обманите «рыжую чуму». Подсуньте ей приманку - кусочек металла с электродным потенциалом выше, чем у стали. Коррозия охотно вцепится в него, забыв про кузов вашего автомобиля как минимум на три год.
И еще один вариант, выпускающийся промышленно и использующий возможности предыдущих (сайт здесь и здесь):
 Катодная защита. Сдвиг потенциала металла осуществлен с помощью внешнего источника постоянного тока или соединением с другим металлом, более электроотрицательным по своему электродному потенциалу (протекторный анод). При этом поверхность защищаемого образца (детали конструкции) становится эквипотенциальной и на всех её участках протекают только катодные процессы, а анодные, обусловливающие коррозию, перенесены на вспомогательные электроды. Если, однако, сдвиг потенциала в отрицательную сторону превысит определённое значение, возможна так называемая перезащита, связанная с выделением водорода, изменением состава приэлектродного слоя и другиии явлениями, что может привести к ускорению коррозии. Катодную защиту, как правило, совмещают с нанесением защитных покрытий; необходимо учитывать возможность отслаивания покрытия.
Катодная защита. Сдвиг потенциала металла осуществлен с помощью внешнего источника постоянного тока или соединением с другим металлом, более электроотрицательным по своему электродному потенциалу (протекторный анод). При этом поверхность защищаемого образца (детали конструкции) становится эквипотенциальной и на всех её участках протекают только катодные процессы, а анодные, обусловливающие коррозию, перенесены на вспомогательные электроды. Если, однако, сдвиг потенциала в отрицательную сторону превысит определённое значение, возможна так называемая перезащита, связанная с выделением водорода, изменением состава приэлектродного слоя и другиии явлениями, что может привести к ускорению коррозии. Катодную защиту, как правило, совмещают с нанесением защитных покрытий; необходимо учитывать возможность отслаивания покрытия.
Итак… КАК «ОНО» РАБОТАЕТ???
Ответ по-УМНОМУ?
В основу работы устройства катодно-протекторной защиты кузова автомобиля от коррозии положен принцип катодной поляризации металла кузова и создания гальванической пары между кузовом автомобиля и дополнительным электродом. При катодной поляризации устройство сообщает железу такой отрицательный потенциал, при котором его окисление становится термодинамически маловероятным. Кроме этого, со временем на металле за счет концентрационной поляризации по кислороду наблюдается дополнительное смещение потенциала в отрицательную сторону.
Ответ по-ПРОСТОМУ?
Катодно-протекторная защита работает так же, как «оцинкованный кузов». Фактически она является его полным аналогом. Только дополнительно предохраняет от появления ржавчины труднодоступные и недоступные места. Например: днище автомобиля со стороны салона, внутренние части передних и задних крыльев, передние и задние пороги, пол в салоне под ногами водителя и пассажиров, внутреннюю поверхность крышки багажника и капота двигателя, задние стенки багажного отделения, потолка салона, внутреннюю поверхность дверей, а так же поврежденные в результате аварии части кузова, провода, контакты, болты и шурупы, гайки, тормозные колодки, диски и т.д. Кроме этого, катодно-протекторная защита частично восстанавливает пораженные ржавчиной участки кузова автомобиля.
ПРЕИМУЩЕСТВА УСТРОЙСТВА КАТОДНО-ПРОТЕКТОРНОЙ ЗАЩИТЫ
Энергопотребление на уровне саморазряда аккамуляторной батареи (АБ не разряжается более года без подзарядки);
Отсутствие соединительных элементов между протекторами и электронным блоком;
Простой монтаж;
Подтвержденная временем эффективность (первая установка была произведена на автомобиле в 2004 году);
Использование в качестве протекторов пластин электролитического цинка;
Расчет массы и количества протекторов по оригинальной методике;
Одновременное использование электронного блока и цинковых протекторов для усиления эффективности;
Долговечность (для легкового автомобиля более 10 лет);
Износостойкость;
Отсутствие эксплуатационных расходов;
Увеличение антикоррозийного ресурса для всего автомобиля в целом (а не локальные воздействия);
Низкая стоимость.
 Установка цинковых протекторов:
Установка цинковых протекторов:
Протекторы закрепляются на кузове автомобиля с помощью болтового соединения в местах, наиболее подходящих для плотного прилегания прямоугольной пластины к поверхности кузова. При этом место контакта должно быть зачищено до металла. Гальваническая пара материалов днища и пластин создает ток, который переносит атомы цинка с пластин на кузов автомобиля. Один раз в два года необходимо выправлять напильником (или наждачной бумагой) образовавшиеся неровности на поверхности каждой пластины.
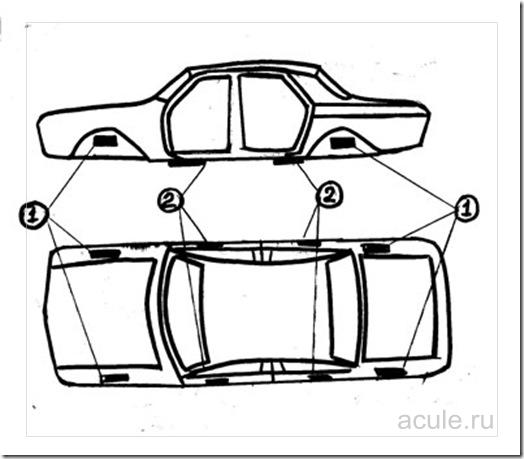 Возможные варианты крепления цинковых пластин:
Возможные варианты крепления цинковых пластин:
Внутренние части крыльев автомобиля.
Места на днище автомобиля под передними из задними порогами.
Установка электронного блока:
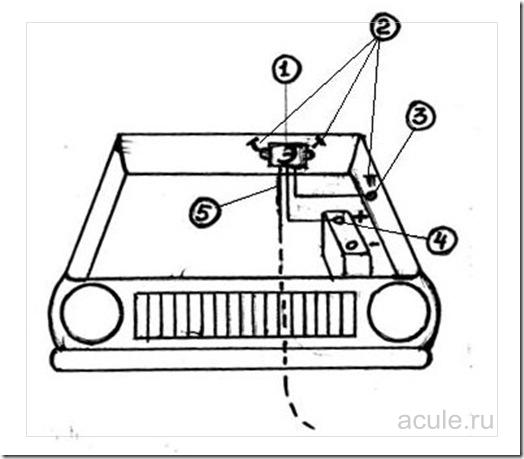 Электронный блок (1) устанавливается в подкапотном пространстве автомобиля, на любую жесткую поверхность с помощью саморезов (2), таким образом, чтобы была возможность спуска гибкого монтажного провода (5).
Электронный блок (1) устанавливается в подкапотном пространстве автомобиля, на любую жесткую поверхность с помощью саморезов (2), таким образом, чтобы была возможность спуска гибкого монтажного провода (5).
Желтый монтажный провод (минус (-), МАССА) крепится к корпусу автомобиля с помощью самореза (3), место контакта должно быть зачищено до металла.
Красный монтажный провод крепится на плюс (4) аккумулятора (+12 В через предохранитель 0,5 А –установлен на проводе!)
Гибкий монтажный провод (5) (спуск на анод) опускается до контакта с землей.
И вот фото еще одного варианта, но на этот раз с защитными электродами подключающимися к блоку с помощью проводов.
 Описывать подробно не стану – все варианты, как видите сами, работают по одному и тому же принципу. Какой выбрать для себя – решайте сами. Если таким способом можно продлить срок службы кузовов, то есть смысл внедрить его и на наших автомобилях.
Описывать подробно не стану – все варианты, как видите сами, работают по одному и тому же принципу. Какой выбрать для себя – решайте сами. Если таким способом можно продлить срок службы кузовов, то есть смысл внедрить его и на наших автомобилях.
