Рассчитать эдс гальванического элемента при стандартных условиях. Измерение эдс гальванических элементов
При изучении этого раздела рекомендуется проработать следующие вопросы: понятие об электродных потенциалах; гальванические элементы (ГЭ); электродвижущая сила гальванического элемента (ЭДС) и ее измерение; стандартный водородный электрод и водородная шкала потенциалов; уравнение Нернста; потенциалы металлических, газовых и окислительно-восстановительных электродов; кинетика электродных процессов; электрохимическая и концентрационная поляризация .
Гальванический элемент – электрохимическая система, состоящая из электродов, погруженных в раствор электролитов и соединенных между собой металлическим проводником, образующим внешнюю цепь элемента.
В основе работы гальванического элемента лежат процессы, происходящие на границе металлический электрод – электролит, в результате которых образуется двойной электрический слой. За счет двойного электрического слоя возникает скачок потенциала, называемого электродным. Величина электродного потенциала металла является количественной характеристикой его активности. Для того, чтобы можно было сравнивать активность различных металлов вводится понятие стандартного электродного потенциала j о. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают ионы.
Величина потенциала металлического электрода зависит от температуры, активности ионов и рассчитывается по уравнению Нернста
где – стандартный электродный потенциал, измеренный относительно водородного электрода при стандартных условиях (Т = 298 K; = 1 моль/л, Р = 1 атм) (табл. 9 приложения);
R – универсальная газовая постоянная;
Т – абсолютная температура, K;
n – число электронов, участвующих в процессе;
F – постоянная Фарадея, равная 96 548 Кл/моль;
– активность ионов металла в растворе, моль/л.
После подстановки значений постоянных и перевода натурального логарифма в десятичный формула Нернста приобретает вид:
Потенциалы водородного и кислородного электродов, являющиеся газовыми электродами, зависят от рН раствора и парциального давления. Потенциалы этих электродов приведены в табл. 10.
Пример 1. Вычислите электродный потенциал водородного электрода в нейтральной среде при = 1 атм.
Решение. Электродный потенциал водородного электрода определяется по уравнению Нернста, исходя из схемы электродного процесса:
окисленная восстановленная
форма форма
Активность ионов водорода в нейтральной среде а = 10 –7 и = 0,
тогда 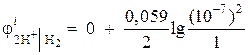 = – 0,418 В.
= – 0,418 В.
Полученное значение сравните с табличным (табл. 10 приложения).
Пример 2. Серебряный электрод опущен в раствор нитрата серебра AgNO 3 с активностью ионов = 1·10 –2 моль/л. Вычислите электродный потенциал.
Решение. Электродный процесс:
окисленная восстановленная
форма форма
Электродный потенциал серебра рассчитывается по уравнению Нернста:
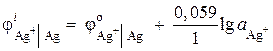 = 0,8 + 0,059× lg10 –2 = 0,682 B.
= 0,8 + 0,059× lg10 –2 = 0,682 B.
Пример 3. Составьте схему гальванического элемента, состоящего из железного и медного электродов, опущенных в растворы собственных солей. Напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС этого ГЭ, если активности ионов в соответствующих растворах следующие: = 1 · 10 –2 моль/л, а = 1,0 моль/л.
Решение. Ионно-электронные уравнения электродных процессов:
А: Fe – 2 ® Fe 2+
K: Cu 2+ + 2 ® Cu
Железный электрод является анодом , так как его стандартный электродный потенциал ( = – 0,44 В) меньше, чем стандартный потенциал медного электрода ( = + 0,34 В) (табл. 9 приложения).
Схема данного в условии гальванического элемента имеет вид:
(–) Fe | Fe 2+ || Cu 2+ | Сu (+)
Определяем ЭДС элемента:
Электродный потенциал анода определяем по уравнению Нернста, а потенциал катода является стандартной величиной:
ЭДС = 0,34 – (– 0,499) = 0,839 В.
Пример 4. Схема гальванического элемента имеет вид:
(–) Zn |ZnCl 2 || ZnCl 2 |Zn (+). Рассчитайте ЭДС этого элемента, если в одном полуэлементе активность ионов цинка 0,001 моль/л, а в другом – 0,01 моль/л. Напишите уравнения анодного и катодного процессов.
Решение. В условии задачи дан концентрационный гальванический элемент. В таком элементе катодом будет цинк, опущенный в раствор соли с более высокой активностью ионов Zn 2+ = 0,01 моль/л.
Уравнение электродных процессов:
А: Zn – 2 ® Zn 2+
K: Zn 2+ + 2 ® Zn
Определяем ЭДС элемента:
Электродные потенциалы находим по уравнению Нернста:
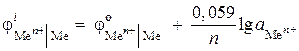 ,
,
ЭДС = – 0,819 – (– 0,848) = 0,029 В.
Пример 5. Для гальванического элемента:
(–) Mn | Mn 2+ || 2H + | H 2 , Ni (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов марганца 1 · 10 –2 моль/л, а ионов водорода 1,0 моль/л (при = 1 атм).
Решение. Уравнения электродных процессов:
А: Mn – 2 ® Mn 2+
K: 2H + + 2 ® H 2 (в кислой среде на катоде идет процесс водородной деполяризации)
При работе гальванического элемента ЭДС и ток уменьшаются. Это связано с изменениями электродных потенциалов анода и катода. Изменение электродных потенциалов, приводящее к уменьшению ЭДС и силы тока, называется поляризацией.
Различают три вида поляризации: газовую, концентрационную и электрохимическую. Разность между равновесным потенциалом электрода и его потенциалом в том же растворе при прохождении электрического тока, называется перенапряжением (табл. 11 приложения).
В условиях данной задачи перенапряжение выделения водорода на катоде = 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю: = 0. Потенциал катода с учетом перенапряжения определяется:
Электродный потенциал анода определяем по формуле . Так как перенапряжение металла на металле условно принято равным нулю, то .
ЭДС = – 0,30 – (–1,239) = 0,939 В.
Пример 6.
Вычислите величину потенциала окислительно-восстановитель-ного электрода Pt | Sn 4+ , Sn 2+ . Реакция восстановления Sn 4+ + 2 ® Sn 2+ протекает в растворе с активностями ионов = 0,1моль/л, = 0,001 моль/л. ![]() .
.
Решение. Потенциал окислительно-восстановительного электрода определяется по уравнению:
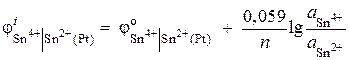 .
.
Пример 7.
Железный электрод в растворе своей соли имеет электродный потенциал ![]() . Вычислите активность ионов в растворе, моль/л.
. Вычислите активность ионов в растворе, моль/л.
Решение. Определяем активность ионов железа, используя уравнение Нернста:
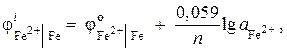
так как = – 0,44 В (табл. 9 приложения), а n = 2, то
![]() ;
;
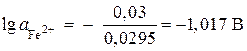 ,
, ![]() моль/л.
моль/л.
Пример 8 . Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие:
Zn + 2Ag + « Zn 2+ + 2Ag ,
если ![]() = – 146,5 кДж/моль, а = 77,2 кДж/моль.
= – 146,5 кДж/моль, а = 77,2 кДж/моль.
Решение. Стандартная ЭДС гальванического элемента определяется по уравнению:
– 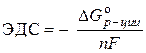 ,
,
где nF – количество электричества, которое теоретически можно получить при электрохимическом превращении одного моля вещества;
F – постоянная Фарадея (F = 96,548 кДж/В · моль), или F » 96 500 Кл/моль,
n – количество электронов, участвующих в процессе, для нашего ГЭ n = 2;
– стандартная энергия Гиббса данной реакции равна:
Так как стандартные энергии Гиббса образования простых веществ цинка и серебра равны нулю, то подставляя числовые значения величин, находим:
= – 146,5 – 2 · 77,2 = – 300,9 кДж.
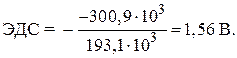
КОНТРОЛЬНЫЕ ЗАДАНИЯ
201. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС цинко-магниевого гальванического элемента, в котором активность ионов цинка = 1·10 –1 моль/л, а ионов магния = 1,0 моль/л.
Ответ: 1,571 В.
202. Для гальванического элемента (–) Cr | Cr 3+ || 2H + | H 2 , Fe (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов хрома = 1·10 –2 моль/л, а ионов водорода = 1,0 моль/л (при = 1 атм).
Ответ: 0,419 В.
203. Алюминиевая и медная пластины соединены внешним проводником и опущены в раствор серной кислоты. Составьте схему гальванического элемента и напишите ионно-электронные уравнения электродных процессов, протекающих на аноде и на катоде.
204. Вычислите электродный потенциал водородного электрода в кислой среде при при = 2 атм и [ H + ] = 1 моль/л.
Ответ: – 9× 10 –3 В.
205. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС железно-ртутного гальванического элемента, в котором активность ионов железа = 1·10 –3 моль/л, а ионов ртути = 1·10 –2 моль/л.
Ответ: 1,319 В.
206. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Mg + 2AgNO 3 ® Mg(NO 3) 2 + 2Ag.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов магния = 0,01 моль/л, а ионов серебра = 0,001 моль/л.
Ответ: 3,043 В.
207. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению:
Zn + Pb(NO 3) 2 ® Zn(NO 3) 2 + Pb.
Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов цинка = 0,001 моль/л, а ионов свинца = 0,01 моль/л.
Ответ: 0,659 В.
208. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Fe 3+ , Fe 2+ если = + 0,77 В, а активности ионов железа в растворе соответственно равны = 0,001 моль/л и = 0,1 моль/л.
Ответ: 0,652 В.
209. Алюминиевый электрод в растворе соли имеет электродный потенциал ![]() . Вычислите активность ионов Al 3+ , моль/л.
. Вычислите активность ионов Al 3+ , моль/л.
Ответ: 0,095 моль/л.
210. Какой гальванический элемент называется концентрационным? Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух медных электродов, опущенных в растворы сульфата меди CuSO 4 c активностью ионов меди в первом растворе = 0,01 моль/л и с = 0,001 моль/л во втором.
Ответ: 0,029 В.
211. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов ионно-электронные уравнения реакций, протекающих на катоде и аноде.
212. При какой активности ионов Mn 2+ (моль/л) потенциал марганцевого электрода будет на 0,018 В меньше его стандартного электродного потенциала?
Ответ: 0,25 моль/л.
213. Потенциал медного электрода в растворе хлорида меди CuCl 2 составил 97% от величины его стандартного электродного потенциала. Чему равна активность ионов , (моль/л)?
Ответ: 0,46 моль/л.
214. Для гальванического элемента
(–) Mg | Mg 2+ || 2H + | H 2 , Cu (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов магния = 1·10 –3 моль/л, а ионов водорода = 1,0 моль/л (при = 1 атм).
Ответ: 1,968 В.
215. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: Mg + Cd 2+ « Mg 2+ + Cd, если активность ионов магния = 0,01 моль/л, а ионов кадмия = 10 –2 моль/л. Напишите уравнения электродных процессов.
Ответ: 0,709 В.
219. Вычислите ЭДС гальванического элемента, в котором при 298 K установилось равновесие: 2Na + H 2 O (г) + 1/2O 2 « 2NaOH (к) ,
если = – 228,76 кДж/моль, а ![]() = – 380,46 кДж/моль.
= – 380,46 кДж/моль.
Ответ: 2,76 В.
220. Вычислите величину потенциала окислительно-восстановительного электрода Pt | Co 3+ , Co 2+ с активностями ионов кобальта = 1 моль/л и = 0,001 моль/л, если ![]() .
.
ТЕРМОДИНАМИКА
ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
к лабораторной работе № 18
Самара 2010
Составители: Ю.П. КОВРИГА, Б.М.СТИФАТОВ, В.В.СЛЕПУШКИН
Термодинамика гальванического элемента: Метод. указ. к лаб. работе. /Сам. гос. техн. ун-т; Сост.: Ю.П.Коврига, Б.М. Стифатов, В.В. Слепушкин .- Самара, 2010. 16 с.
Рассмотрены теоретические основы и экспериментальное определение термодинамических характеристик электрохимических реакций, протекающих при работе гальванического элемента.
Указания рассчитаны на студентов химических и других специальностей, изучающих электрохимию в курсе физической химии.
Табл. 1. Ил. 2. Библиогр.: 6 назв.
Печатается по решению редакционно-издательского совета СамГТУ.
Цель работы – изучение теории и практики термодинамических расчетов для электрохимических реакций, протекающих при работе обратимых гальванических элементов по результатам измерения электродвижущей силы.
1. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Термодинамические характеристики
Гальванического элемента
Гальваническим элементом называется система из двух электродов, в которой энергия химической реакции самопроизвольно преобразуется в электрическую. Он состоит из двух электродов (полуэлементов), погруженных в растворы электролитов. Между этими растворами устанавливают контакт с помощью пористой перегородки или электролитического мостика, т. е. сифонной трубки, наполненной насыщенным раствором KCl или NH 4 NO 3 . Пористая перегородка или электролитический мостик обеспечивают электрическую проводимость между электродными растворами, но препятствуют их взаимной диффузии. В некоторых случаях оба электрода бывают погружены в один и тот же раствор.
Если соединить электроды металлическим проводником, на одном из них происходит реакция окисления, причем он заряжается отрицательно и называется анодом , а на другом - реакция восстановления, он заряжается положительно и называется катодом .
Темодинамика – это раздел науки, изучающий взаимные превращения теплоты в работу и обратно. Химическая термодинамика – это раздел физической химии, изучающий физико-химические процессы, сопровождающиеся выделением или поглощением энергии. Гальванический элемент относится к физико-химическим системам. Следовательно, работа гальванического элемента, как любой другой термодинамической системы, характеризуется термодинамическими величинами изменения энергии Гиббса ΔG, энтальпии ΔН, энтропии ΔS и константой равновесия К а для электрохимических реакций, протекающих при работе обратимых гальванических элементов.
Чем большим сопротивлением обладает соединяющий электроды проводник, тем медленнее протекают реакции на электродах. Принципиально можно замкнуть электроды проводником бесконечно большого сопротивления, и реакция будет идти бесконечно медленно, т. е. обратимо .
При изотермическом и обратимом проведении химической реакции работа получается наибольшей: в таком случае наибольшая часть теплоты реакции превращается в электрическую работу. Измеренная при этом разность потенциалов между электродами носит название электродвижущей силы (коротко - ЭДС) гальванического элемента.
Электрическая работа гальванического элемента (А ) равна его ЭДС (Е ),умноженной на переносимый заряд (q ). Если во время реакции произойдет восстановление или окисление z мольэквивалентов вещества, то по закону Фарадея будет перенесено q = zF кулонов (А . с) электричества, где F - число Фарадея (96500 Кл/моль). Следовательно, максимальная работа (А" max ) по переносу zF кулонов электричества через разность потенциалов (Δφ = E) электродов гальванического элемента равна
где Е – ЭДС гальванического элемента, В; Е 0 – стандартная ЭДС гальванического элемента при единичных активностях участников реакции; a(OX 1),a(Red 1),a(OX 2),a(Red 2) – активные концентрации (активности) окислительно-восстановительных сопряженных пар OX 1 / Red 1 и OX 2 /Red 2 , образующихся в результате реакции в растворе.
Измерение ЭДС гальванического элемента E и ее изменения с температурой dE/dT позволяет вычислить важнейшие термодинамические величины для химической окислительно-восстановительной реакции, протекающей в элементе.
Из уравнения Гиббса-Гельмгольца
Из уравнения (8) следует, что
Величина д E/д T называется температурным коэффициентом ЭДС гальванического элемента .Температурный коэффициент д E/д Tможет быть определен по зависимости ЭДС гальванического элемента от температуры. Величина д E/д T может быть положительной, отрицательной и равной нулю в зависимости от природы гальванического элемента.
При д E/д T = 0, т. е. когда ЭДС элемента не зависит от температуры, Е = - ΔU /zF. В этом случае работа элемента происходит целиком за счет убыли внутренней энергии системы без выделения или поглощения теплоты.
При д E/д T <0, т.е. когда ЭДС элемента уменьшается с повышением температуры, работа элемента совершается тоже за счет убыли внутренней энергии системы, но сопровождается выделением теплоты. В этом случае работа элемента и расход энергии на нагревание окружающей среды осуществляется за счет убыли внутренней энергии системы.
При д E/д T >0, т.е. когда ЭДС элемента возрастает с повышением температуры, элемент работает с поглощением теплоты. В этом случае соотношение между Е и Т . д E/д T определяет характер работы и направление изменения внутренней энергии системы:
1) когда Е = Т д E/д T, внутренняя энергия работающего элемента при постоянной температуре не изменяется: ΔU = 0. Работа элемента совершается целиком за счет теплоты, поглощаемой из окружающей среды;
2) когда Е > Т . д E/д T, внутренняя энергия элемента при его работе убывает, ΔU <0, и работа совершается частично за счет убыли внутренней энергий и частично за счет поглощения теплоты извне;
3) когда E < Т . д E/д T внутренняя энергия элемента при его работе возрастает, ΔU > 0, т.е. элемент поглощает теплоту в количестве, превышающем совершаемую им работу. Избыток поглощенной теплоты идет на повышение внутренней энергия системы. Здесь работа совершается, и процесс протекает самопроизвольно, несмотря на эндотермичность химической реакции.
Величина д E/д T приближенно может быть вычислена по формуле
| | (11) |
где Е 1 и Е 2 – – значения ЭДС гальванического элемента при температурах Т 1 и Т 2 . Расчет будет тем точнее, чем меньше отличаются между собой Т 1 и Т 2 , т.к. зависимость Е = f(Т) близка к линейной только для небольших интервалов температур.
Константа равновесия химической реакции К а может бытьподсчитана из уравнений изотермы химической реакции в стандартных условиях. По уравнению изотермы Вант-Гоффа величину максимально полезной работы для химической реакции рассчитывают как
| , | (14) |
где Е 0 = Е 0 2 – Е 0 1 – стандартная ЭДС, равная разности стандартных электродных потенциалов.
Расчет константы равновесия ведут, используя справочные данные по величинам стандартных электродных потенциалов соответствующих электродов, приведенных в справочнике физико-химических величин .
Измерение ЭДС гальванических элементов
Изменение термодинамических величин электрохимических реакций весьма точно можно определить, измеряя электродвижущие силы гальванических элементов, в которых протекают эти реакции. Точность этого метода объясняется высокой точностью измерений ЭДС гальванического элемента потенциометром типа Р-307, работающим по компенсационному методу Поггендорфа . Он обеспечивает измерение ЭДС гальванического элемента в условиях, когда через элемент протекает ток бесконечно малой величины, что соответствует обратимому гальваническому элементу. При измерении ЭДС с помощью обыкновенного вольтметра через электроды протекает ток, вырабатываемый элементом, что приводит к сдвигу потенциалов электродов от равновесных значений, которым соответствует уравнение Нернста.
Измерение ЭДС элемента в условиях равновесия, протекающей на его электродах окислительно-восстановительной реакции, достигается применением компенсационного метода Поггендорфа, реализуемого с помощью электрической схемы, приведенной на рис. 2.
нормальным ) гальванический элемент Вестона
Θ Сd(Hg) | CdSO 4 8/3H 2 O(нас.), Hg 2 SO 4 (т) | Hg ,
имеющий постоянную и воспроизводимую величину ЭДС. Здесь анод - амальгама кадмия, а катод - металлическая ртуть. При замыкании цепи протекают полуреакции:
При 25 0 С ЭДС элемента Вестона равна 1,0183 В.
Измерение начинают с градуировки шкалы реохорда, представляющего градуированную в мм линейку с натянутой на нее нихромовой проволокой постоянного сечения.
К схеме подключают аккумулятор, обеспечивающий постоянный электрический ток в цепи. Переключателем «П» вводят в цепь стандартный элемент и перемещают по проволоке реохорда передвижной контакт «С». Периодически кратковременным нажатием ключом «К» замыкают цепь, проверяя по гальванометру наличие тока в цепи, т.е. компенсации. В момент компенсации отрезок AC проволоки реохорда отвечает тому сопротивлению, произведение которого на ток аккумулятора, равно напряжению, компенсирующему ЭДС элемента Вестона. Зная длину отрезка AC (например, l N ),на котором падение напряжения аккумулятора компенсирует ЭДС (E N) элемента Вестона, можно вычислить падение напряжения на 1 мм реохорда, как E N /l N , В/мм.
Затем в схему включают исследуемый гальванический элемент с неизвестной величиной ЭДС E Х и повторяют указанные выше измерительные операции, измеряя в момент компенсации длину отрезка проволоки реохорда l Х . Из соотношения
находят неизвестное значение ЭДС.
Для точного измерения ЭДС гальванического элемента применяют высокоомный потенциометр Р-307 , вид верхней панели которого показан на рис. 2.
Работа прибора основана на принципе компенсации, когда в момент измерения ЭДС ток в цепи исследуемого гальванического элемента имеет бесконечно малую величину (ноль на нуль-инструменте (гальванометре)). Собирая измерительную схему, присоединяют к клеммам «Б» батарею или выпрямитель на 2,5 - 3,5 В, к клеммам «НЭ» - нормальный элемент Вестона, к клеммам X 1 или Х 2 - исследуемый гальванический элемент. При этом во всех случаях учитывают знаки полярности «+» и «-» на панели прибора и подключаемом источнике постоянного тока. Гальванометр присоединяют к соответствующим клеммам «Г». После этого подключают потенциометр через выпрямитель к электрической сети.
Работу начинают с калибровки прибора по эталонному элементу Вестона.
Переключатель рода работ (3) ставят в положение «НЭ». Ручками сопротивлений (2) производят «грубо», а затем «тонко» компенсацию ЭДС элемента Вестона, периодически замыкая измерительную цепь кнопкой 430 кОм, затем кнопкой «0». Правильной настройке соответствует отсутствие тока в цепи гальванометра при кратковременном замыкании (1-2 с) ее кнопкой «0».
В результате на измерительные ручки (5) потенциометра подается от выпрямителя рабочий ток, обеспечивающий на суммарном сопротивлении этих ручек напряжение, равное ЭДС элемента Вестона, т.е. 1,0186 В.
|
||||
| Рис. 2. Вид верхней панели потенциометра Р-308: 1 – гнезда «Х 1 » и «Х 2 » для подключения электродов гальванического элемента; 2 – ручки сопротивлений «грубо» «тонко» для калибровки потенциометра; 3 – переключатель работы потенциометра на нормальный (НЭ) или исследуемый элемент«НЭ» или «Х 2 »; 4 - гнезда «Г» для подключения гальванометра; 5 - ручки сопротивлений (декады) с окнами для измерения численных значений ЭДС; 6 - гнезда «Х 1 » для подключения нормального элемента Вестона; 7 - гнезда «Б» и для подключения аккумулятора; 8 - нормальный элемент Вестона; 9 – выпрямитель переменного тока; 10 - гальванометр; 11 – окна цифровых значений ЭДС; 12 - кнопки замыкания измерительной цепи «430» и «0» и упокоения колебаний стрелки гальванометра «Усп». |
Измерительные ручки называют декадами , так как каждая из них имеет 10 положений. Каждое из положений первой декады (I), обеспечивает сопротивление, которое умноженное на рабочий ток, дает компенсационное значение ЭДС, равное 0,1 В. Следовательно, ручка (I), позволяет компенсировать от 0,1 до 1 В. Декада (II) позволяет компенсировать от 0,01 до 0,1 В и т.д. Поэтому измеренное цифровое значение ЭДС, указанное в окошке для первой декады, следует умножать на 0,1, для второй – на 0,01 и т.д.
После калибровки прибора переключатель рода работ (2) ставят в положение X 1 или Х 2 (в зависимости от того, к какому зажиму подключен исследуемый гальванический элемент) и ручками декад переключателей I - VI проводят уравновешивание измеряемой ЭДС при последовательном увеличении чувствительности, добиваясь отсутствия тока в цепи при кратковременном замыкании кнопкой «0».
Значение измеряемой величины отсчитывается по цифрам в окошечках с соответствующими множителями.
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
План работы
1. Ознакомиться с теоретическими основами термодинамики гальванического элемента.
2. Собрать исследуемый гальванический элемент и поместить его в гнезда в крышке термостата.
3. Подключить соединительными проводами исследуемый гальванический элемент к потенциометру Р-308.
4. Откалибровать потенциометр Р-308 с помощью стандартного элемента Вестона.
5. Измерить ЭДС исследуемого гальванического элемента в указанном в задании интервале температур, меняя температуру термостата.
7. Оформить отчет о проделанной работе и сделать вывод о соответствии значений рассчитанных величин процессам, протекающим в гальваническом элементе.
8. Проверить результаты работы у преподавателя и привести в порядок рабочее место.
Приборы и реактивы
1. Платиновые электроды с соединительными проводами (2 шт.).
2. Широкогорлые стеклянные пробирки (2 шт.).
3. Термостат.
4. Потенциометр Р-308.
5. Выпрямитель переменного тока.
6. Стандартный элемент Вестона.
7. Растворы для приготовления гальванического элемента.
8. Стеклянная трубка солевого мостика.
9. Насыщенный раствор KCl.
10. Фильтровальная бумага для изготовления пробок солевого мостика.
Ход выполнения работы
1. Составляют гальванический элемент, указанный в задании на работу. Для этого в две большие широкогорлые пробирки налить соответствующие растворы заданной концентрации.
2. Опустить платиновые электроды в соответствующие электролиты.
3. Поместить пробирки с растворами в гнезда в крышке термостата.
4. Изготовить солевой мостик, заполнив П-образную стеклянную трубку насыщенным раствором KCl и заткнуть отверстия так, чтобы в солевом мостике не было пузырьков воздуха.
5. Соединяют пробирки солевым мостиком.
6. Откалибровать потенциометр Р-308 по элементу Вестона.
7. Измерить ЭДС собранного гальванического элемента в интервале температур, указанном в задании на работу, повышая температуру воды в термостате. Температура в термостате точно измеряется отдельным термометром. Записать измеренное значение ЭДС и соответствующую ей температуру.
9. Определить по справочнику стандартные потенциалы электродов исследуемого гальванического элемента и составить его схему. Составить уравнение полуреакций, протекающих на электродах, и общее уравнение окислительно-восстановительной реакции. Рассчитать стандартную величину ЭДС элемента и найти константу равновесия К а по формуле (14).
10. Занести результаты эксперимента и расчетные величины в таблицу.
1. Связь между энергией Гиббса электрохимической реакции и ЭДС гальванического элемента.
2. Вывод формул для расчета ΔG, ΔН, ΔS электрохимической реакции.
3. Зависимость ЭДС гальванических элементов от температуры.
4. Понятие «температурный коэффициент ЭДС» и методы его определения.
5. Связь между знаком температурного коэффициента и характером электрохимической реакции.
6. Принцип действия потенциометра Р-307.
7. Методика выполнения работы.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Семченко Д.П., Стромберг А.Г . Физическая химия.- М.: Высш. шк., 2000. - 512 с.
2. Практикум по физической химии / Под ред. И.В. Кудряшова. - М.: Высш. шк., 1999.- 400 с.
3. Практикум по физической химии / Под ред. В.В. Буданова,
Н.К. Воробьёва. - М.: Химия, 2000. – 387 с.
4. Практические работы по физической химии: Учеб. пособ. для вузов /Под ред. К.П. Мищенко, А.А. Равделя, А.М. Пономаревой.- СПб, изд-во «Профессия», 2002. – 384с.
5. Краткий справочник физико-химических величин /Под ред. А.А. Равделя, А. М. Пономаревой. - М.: Химия, 2002. - 327 с.
6. Киселева Е. В., Каретников Г. С., Кудряшов И. В. Сборник примеров и задач по физической химии. - М.: Высш. шк., 2001. – 389 с.
Превращение химической энергии в электрическую происходит в электрохимических системах, которые называются гальваническими элементами.
Гальванический элемент представляет собой замкнутую электрохимическую систему, состоящую из двух электродов.
Рассмотрим гальванический элемент Якоби-Даниэля. Он состоит из медной пластины, погруженной в раствор CuSC4, и цинковой пластины, погруженной в раствор ZnSC4. Для предотвращения прямого взаимодействия окислителя и восстановителя электроды отделены друг от друга пористой перегородкой.
Схема гальванического элемента:
Zn | ZnSO4| | CuSO4| Cu,
Zn | Zn2+ | | Cu2+ | Cu.
На поверхности цинковой пластины возникает двойной электрический слой и устанавливается равновесие:
В результате протекания этого процесса возникает электродный потенциал цинка.
На поверхности медной пластины также возникает двойной электрический слой и устанавливается равновесие:
Сu2+ + 2е « Сu, поэтому возникает электродный потенциал меди.
Потенциал цинкового электрода имеет более отрицательное значение, чем потенциал медного электрода, поэтому при замыкании внешней цепи, т. е. при соединении цинка с медью метал лическим проводником, электроны будут переходить от цинка к меди.
Таким образом, при замыкании внешней цепи возникают самопроизвольные процессы растворения цинка на цинковом электроде и выделения меди на медном электроде. Данные процессы будут продолжаться до тех пор, пока не выровняются потенциалы электродов или не растворится весь цинк (или не высадится на медном электроде вся медь).
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е « Сu.
Процессы восстановления в электрохимии получили название катодных процессов, а электроды, на которых идут процессы восстановления, называют катодами;
движение электронов во внешней цепи;
движение ионов в растворе: анионов (SO4-2) к аноду, катионов (Cu2+, Zn2+) к катоду. Движение ионов в растворе замыкает электрическую цепь гальванического элемента. Суммируя электродные реакции, получаем:
Zn + Cu2+ = Zn2+ + Сu.
Вследствие этой химической реакции в гальваническом элементе возникает движение электронов во внешней цепи и ионов внутри элемента, т. е. образуется замкнутая электрическая система и в ней возникает электрический ток. Суммарная химическая реакция, протекающая в гальваническом элементе, называется токообразующей.
Электрический ток, возникающий в данной электрохимической системе, численно характеризуется величиной электродвижущей силы (ЭДС) элемента. Она равна разности электродных потенциалов катода и анода:
В стандартных условиях самопроизвольное протекание химической реакции возможно, когда максимальная полезная работа, совершаемая в результате данной реакции, равна отрицательной величине изменения свободной энергии:
В гальваническом элементе совершаемая максимальная электрическая работа в стандартных условиях равна ЭДС элемента, умноженной на количество электричества (nF), т. е.
А = nFE0, (7.5)
где n - число электронов, участвующих в реакции;
F- постоянная Фарадея, равная 96500 Кл/моль;
E0 - стандартная ЭДС гальванического элемента (T= 298 К, молярная концентрация электролитов равна 1 моль/дм3). Таким образом, максимальная работа гальванического элемента равна:
А =-DG0= nFE0. (7.6)
Стандартная ЭДС гальванического элемента равна:
Гальванические элементы в зависимости от природы электродов и концентрации электролитов разделяют на химические и концентрационные.
Химические гальванические элементы - это такие элементы, где электроды и электролиты различны. Примером химического гальванического элемента является элемент Якоби-Даниэля.
Концентрационные гальванические элементы - это такие элементы, которые состоят из одинаковых электродов, но концентрации электролитов различны, например, серебряные электроды, погруженные в растворы нитрата серебра разной концентрации:
Ag | AgNO3 (0,01 моль/дм3) | | AgNO3 (0,1 моль/дм3) | Ag.
Пример 1 . Гальванический элемент состоит из металлического цинка, погруженного в раствор нитрата цинка с молярной концентрацией 0,1 моль/дм3, и металлического свинца, погруженного в раствор нитрата свинца с молярной концентрацией 0,02 моль/дм3 Вычислите ЭДС элемента, напишите уравнения электродных процессов, составьте схему элемента.
Решение. Чтобы определить ЭДС элемента, необходимо вычислить электродные потенциалы по уравнению Нернста (7.2):
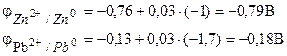
Находим ЭДС элемента по формуле (7.3).
3.5.1 Электрические потенциалы на фазовых границах
При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди.
При
погружении медного электрода в воду
часть ионов меди, находящихся в узлах
кристаллической решетки, в результате
взаимодействия с диполями воды будет
переходить в раствор. Возникающий при
этом на электроде отрицательный заряд
будет удерживать перешедшие в раствор
ионы в приэлектродном пространстве –
образуется двойной электрический
слой (рис. 3.12а; о моделях строения ДЭС
смотрите п. 4.2.4). Отрицательный заряд на
электроде будет препятствовать
дальнейшему переходу ионов меди в
раствор, и через некоторое время
установится динамическое равновесие,
которое можно однозначно
охарактеризовать потенциалом
электрического поля ДЭС Φ,
зависящего от заряда на электроде, или
некоторой равновесной концентрацией
ионов в приэлектродном слое С o .
При погружении медного электрода в
раствор СuSО 4 , содержащий ионы меди
в концентрации С возможны три
случая:
Рис. 3.12
Схема двойного электрического
слоя на границе электрод-раствор
1. С < С o . Поскольку концентрация ионов меди в поверхностном слое меньше равновесной, начнется переход ионов из электрода в раствор; электрод заряжается отрицательно, в поверхностном слое раствора катионов будет больше, чем анионов (рис. 3.9а).
2. С > С o . Поскольку концентрация ионов меди в поверхностном слое больше равновесной, начнется переход ионов из раствора в электрод; на электроде возникает положительный заряд и в поверхностном слое преобладают анионы SО 4 2- (рис. 3.12b).
3. С = С o . Поскольку концентрация ионов меди в поверхностном слое равна равновесной (такие растворы называют нулевыми), заряд на электроде не возникает, двойной электрический слой не образуется.
3.5.2 Гальванический элемент. ЭДС гальванического элемента
Рассмотрим простейший гальванический элемент Даниэля – Якоби, состоящий из двух полуэлементов – цинковой и медной пластин, помещенных в растворы сульфатов цинка и меди соответственно, которые соединены между собой посредством электролитического ключа – например, полоски бумаги, смоченной раствором какого-либо электролита. Схематически данный элемент изображается следующим образом:
Zn / Zn 2+ // Cu 2+ / Cu
На поверхности каждого из электродов имеет место динамическое равновесие перехода ионов металла из электрода в раствор и обратно, характеризуемое потенциалом ДЭС (зарядом на электроде q). Если соединить медный и цинковый электроды металлическим проводником, немедленно произойдет перераспределение зарядов – электроны начнут перемещаться с электрода с более отрицательным зарядом (в нашем случае – цинкового) на электрод с более положительным зарядом (медный), т.е. в проводнике возникнет электрический ток. Изменение величины заряда каждого из электродов нарушает равновесие – на цинковом электроде начнется процесс перехода ионов из электрода в раствор (окисление металла), на медном – из раствора в электрод (восстановление металла); при этом протекание процесса на одном электроде обусловливает одновременное протекание противоположного процесса на другом:
Zn o ––> Zn 2+ + 2е -
Сu 2+ + 2е - ––> Сu o
Электрод, на котором при работе гальванического элемента протекает процесс окисления, называется анодом , электрод, на котором идет процесс восстановления – катодом . При схематическом изображении гальванических элементов слева записывают анод, справа – катод (стандартный водородный электрод всегда записывают слева). Суммарный окислительно-восстановительный процесс, происходящий в гальваническом элементе, выражается следующим уравнением:
Сu 2+ + Zn o ––> Сu o + Zn 2+
Т.о., гальванический элемент можно определить как прибор для преобразования химической энергии окислительно-восстановительной реакции в электрическую за счет пространственного разделения процессов окисления и восстановления. Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью электрических потенциалов между электродами (называемой обычно просто разностью потенциалов) ΔΦ и количеством прошедшего по цепи электричества q:
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала. Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (ЭДС) гальванического элемента .
3.5.3 Электродный потенциал. Уравнение Нернста
ЭДС гальванического элемента E удобно представлять в виде разности некоторых величин, характеризующих каждый из электродов – электродных потенциалов; однако для точного определения этих величин необходима точка отсчета – точно известный электродный потенциал какого-либо электрода. Электродным потенциалом электрода ε э называется ЭДС элемента, составленного из данного электрода и стандартного водородного электрода (см. ниже), электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают положительным, если в таком гальваническом элементе испытуемый электрод является катодом, и отрицательным, если испытуемый электрод является анодом. Необходимо отметить, что иногда электродный потенциал определяют как "разность потенциалов на границе электрод – раствор", т.е. считают его тождественным потенциалу ДЭС, что не вполне правильно (хотя эти величины взаимосвязаны).
Величина электродного потенциала металлического электрода зависит от температуры и активности (концентрации) иона металла в растворе, в который опущен электрод; математически эта зависимость выражается уравнением Нернста (здесь F – постоянная Фарадея, z – заряд иона):
В уравнении Нернста ε ° – стандартный электродный потенциал , равный потенциалу электрода при активности иона металла, равной 1 моль/л. Стандартные электродные потенциалы электродов в водных растворах составляют ряд напряжений. Величина ε ° есть мера способности окисленной формы элемента или иона принимать электроны, т.е. восстанавливаться. Иногда различием между концентрацией и активностью иона в растворе пренебрегают, и в уравнении Нернста под знаком логарифма фигурирует концентрация ионов в растворе. Величина электродного потенциала определяет направление процесса, протекающего на электроде при работе гальванического элемента. На полуэлементе, электродный потенциал которого имеет большее (иногда говорят – более положительное) значение, будет протекать процесс восстановления, т.е. данный электрод будет являться катодом.
Рассмотрим расчёт ЭДС элемента Даниэля – Якоби с помощью уравнения Нернста. ЭДС всегда является положительной величиной и равна разности электродных потенциалов катода и анода:
![]() (III.42)
(III.42)
![]() (III.43)
(III.43)
![]() (III.45)
(III.45)
Как видно из уравнения (III.45), ЭДС элемента Даниэля – Якоби зависит от концентрации (точнее говоря, активности) ионов меди и цинка; при их равных концентрациях ЭДС элемента будет равна разности стандартных электродных потенциалов:
![]() (III.46)
(III.46)
Анализируя уравнение (III.45), можно определить предел необратимой работы гальванического элемента. Поскольку на аноде идет процесс окисления цинка, концентрация ионов цинка при необратимой работе гальванического элемента постоянно увеличивается; концентрация ионов меди, напротив, уменьшается. Отношение концентраций ионов меди и цинка постоянно уменьшается и логарифм этого отношения при [Сu 2+ ] < становится отрицательным. Т.о., разность потенциалов при необратимой работе гальванического элемента непрерывно уменьшается; при E = 0 (т.е. ε к = ε а) гальванический элемент не может совершать работу (необратимая работа гальванического элемента может прекратиться также и в результате полного растворения цинкового анода).
Уравнение (III.45) объясняет также и работоспособность т.н. концентрационных цепей – гальванических элементов, состоящих из двух одинаковых металлических электродов, опущенных в растворы соли этого металла с различными активностями а 1 > а 2 . Катодом в этом случае будет являться электрод с большей концентрацией, т.к. стандартные электродные потенциалы обоих электродов равны; для ЭДС концентрационного гальванического элемента получаем:
![]() (III.47)
(III.47)
Единственным результатом работы концентрационного элемента является перенос ионов металла из более концентрированного раствора в менее концентрированный. Т.о., работа электрического тока в концентрационном гальваническом элементе – это работа диффузионного процесса, который проводится обратимо в результате пространственного разделения его на два противоположных по направлению обратимых электродных процесса.
Copyright
© С. И. Левченков,
1996 - 2005.
